Константа химического равновесияБольшинство химических реакций обратимы, т.е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакции идут с одинаковой скоростью, наступает химическое равновесие. Например, в обратимой гомогенной реакции: H2(г) + I2(г) ↔ 2HI(г) соотношение скоростей прямой и обратной реакций согласно закону действующих масс зависит от соотношения концентраций реагирующих веществ, а именно: скорость прямой реакции: υ1 = k1[Н2][I2]. Скорость обратной реакции: υ2 = k2 [HI]2. Если H2 и I2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования H2 и I2 и образования HI скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Спустя некоторое время обе скорости уравниваются, и в системе устанавливается химическое равновесие, т.е. число образующихся и расходуемых молекул HI в единицу времени становится одинаковым. Так как при химическом равновесии скорости прямой и обратной реакций равны V1 = V2, то k1 [H2] [I2]= k2 [HI]2.
Поскольку k1 и k2 при данной температуре постоянны, то их отношение будет постоянным. Обозначая его через K, получим:
К – называется константой химического равновесия, а приведенное уравнение – законом действующих масс (Гульдберга - Ваале). В общем случае для реакции вида аА+bB+…↔dD+eE+… константа равновесия равна Состояние равновесия характеризует тот предел, до которого в данных условиях реакция протекает самопроизвольно (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0. Соотношение между равновесными концентрациями не зависит от того, какие вещества берутся в качестве исходных (например, H2 и I2 или HI), т.е. к состоянию равновесия можно подойти с обеих сторон. Константа химического равновесия зависит от природы реагентов и от температуры; от давления (если оно слишком высокое) и от концентрации реагентов константа равновесия не зависит. Влияние на константу равновесия температуры, энтальпийного и энтропийного факторов. Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции ∆Go простым уравнением ∆Go=-RT ln K. Из него видно, что большим отрицательным значениям ∆Go (∆Go<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆Go характеризуется большими положительными значениями (∆Go>>0), то в равновесной смеси преобладают исходные вещества. Указанное уравнение позволяет по величине ∆Go вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если учесть, что ∆Go=∆Нo-Т∆So, то после некоторого преобразования получим
|



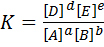 . Для взаимодействия между газообразными веществами часто пользуются выражением
. Для взаимодействия между газообразными веществами часто пользуются выражением  , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции
, в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции 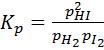 .
. . Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
. Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.


