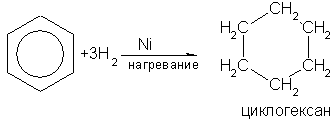M – масса чистого веществаM - масса сплава или раствора. Задачи на сплавы и растворы удобно решать с помощью таблицы. Порядок заполнения таблицы такой: 1. Сначала решаем, какую величину мы примем за неизвестное, и заполняем тот столбец таблицы, в котором речь идет об этой величине. 2. Заполняем тот столбец, параметры которого даны. 3. Параметры третьего столбца выражаем через параметры первых двух. Поясню алгоритм решения задачи на сплавы и растворы на примере данной задачи. 1. Поскольку в условии масса первого раствора не указана, примем ее за х. Масса второго раствора равна массе первого и тоже равна х. После того, как растворы смешали, мы получила раствор, масса которого равна 2х. Начнем заполнять таблицу:
2. В условии задачи дано процентное содержание вещества в каждом растворе. Внесем эти условия в соответствующий столбец таблицы:
3. Параметры второго столбца, то есть массу чистого вещества выразим через параметры первых двух. Для этого воспользуемся формулой: m=
массе вещества: 0,15х+0,19х=0,34х разделить на массу раствора: 2х. Получим: Р= Ответ: 17%. Билет № 7 1. Растворы. Растворимость Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия. По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). Размеры частиц в истинных растворах - менее 10-9 м (порядка размеров молекул). Ненасыщенные, насыщенные и перенасыщенные растворы Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 200C растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества.
Поместив в 100 г воды при 200C меньше 36 г NaCl мы получим ненасыщенный раствор.
При нагревании смеси соли с водой до 1000C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 200C, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном. Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
Растворение как физико-химический процес
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются: – поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах; – выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH-выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры). Растворимость
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества. Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды); Н - нерастворимые (менее 0,1 г на 100 г воды). (Смотри таблицу растворимости)
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается. Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается. 2. Арены. Бензол Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи - ядро бензола. Международное название ароматических углеводородов - арены. Простейшим представителем аренов является бензол С6Н6. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым. Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола. Электронное строение бензола. p-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):
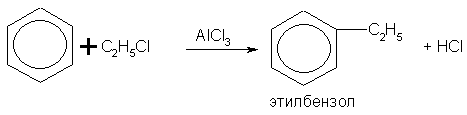
Свойства. Бензол - бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим. Горит сильно коптящим пламенем. Пары бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары бензола ядовиты. При обычных условиях большинство ароматических углеводородов также представляют собой бесцветные жидкости, нерастворимые в воде, обладающие характерным запахом. По химическим свойствам бензол и другие ароматические углеводороды отличаются от предельных и непредельных углеводородов. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений. Так, при взаимодействии бензола с бромом (в присутствии катализатора FеВr2) атом водорода замещается атомом брома:
Бромбензол - бесцветная жидкость, нерастворимая в воде. При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
Гексахлорбензол - бесцветное кристаллическое вещество, применяемое для протравливания семян и консервирования древесины. Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается нитрогруппой — NО2:
Это реакция нитрования бензола. Нитробензол - бледно-желтая маслянистая жидкость с запахом горького миндаля, нерастворима в воде, применяется в качестве растворителя, а также для получения анилина. В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:
Реакции присоединения к бензолу протекают с большим трудом. Для их протекания необходимы особые условия: повышение температуры и давления, подбор катализатора, световое облучение и др. Так, в присутствии катализатора - никеля или платины - бензол гидрируется, т.е. присоединяет водород, образуя циклогексан:
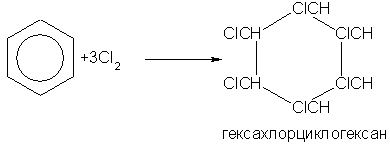
Циклогексан – бесцветная летучая жидкость с запахом бензина, в воде нерастворим. При ультрафиолетовом облучении бензол присоединяет хлор:
Гексахлорциклогексан, или гексахлоран, - кристаллическое вещество, применяется как сильное средство для уничтожения насекомых. Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишьрадикалы, связанные с бензольным кольцом:
Таким образом, ароматические углеводороды могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов. Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах. Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором (платиновой чернью) при 300°С. Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга. По способу Н.Д. Зелинского и Б.А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 600° С трубку с активированным углем. Весь процесс полимеризации трех молекул ацетилена можно изобразить схемой
Значительную часть получаемого бензола используют для синтеза других продуктов: · около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом); · около 25 % бензола превращают в кумол (алкилирование бензола пропиленом); · приблизительно 10—15 % бензола гидрируют в циклогексан; · около 10 % бензола расходуют на производство нитробензола; · 2—3 % бензола превращают в линейные алкилбензолы; · приблизительно 1 % бензола используется для синтеза хлорбензола. В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя. Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавляли deru в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %. 3. Расставить коэффициенты в реакции Al + O2 = Al2O3 И здесь атомов каждого элемента разное количество до реакции и после нее. Выравнивать начинаем с газа - с молекул кислорода: 1) Слева 2 атома кислорода, а справа 3. Ищем наименьшее общее кратное двух этих чисел. Это наименьшее число, которое делится и на 2, и на 3, т.е. 6. Перед формулами кислорода и оксида алюминия Al2O3 ставим такие коэффициенты, чтобы общее число атомов кислорода в этих молекулах было 6: Al + 3O2 = 2Al2O3 2) Считаем число атомов алюминия: слева 1 атом, а справа в двух молекулах по 2 атома, т.е.4. Перед знаком алюминия в левой части уравнения ставим коэффициент 4: 4Al + 3O2 => 2Al2O3 3) Еще раз пересчитываем все атомы до реакции и после нее: по 4 атома алюминия и по 6 атомов кислорода. Билет № 8
|



 xM:
xM: Процентное содержание вещества в получившемся растворе равно
Процентное содержание вещества в получившемся растворе равно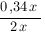 x100%=17%
x100%=17%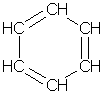
 . В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей
. В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей  .
.