ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. 1. Степень окисления атома марганца в перманганате калия равна
1. Степень окисления атома марганца в перманганате калия равна …. 1) +6 2) +4 3) +7 4) +2
2. Степень окисления атома азота в азотистой кислоте равна …. 1) –3 2) +3 3) +5 4) +4
3. Степени окисления атомов марганца в КМnО4, К2МnО4, МnО, МnО2 соответственно равны …. 1) +4, +2, +6, +7 2) +6, +7, +4, +2 3) +6, +2, +4, +7 4) +7, +6, +2, +4
4. Степени окисления атома хрома в хромате калия К2СrО4, дихромате калия К2Сr2О7 и сульфата хрома Сr2(SО4)3 соответственно равны …. 1) +3, +6, +3 2) +3, +3, +6 3) +6, +6, +3 4) +3, +6, +6
5. Высшая и низшая степени окисления атома хлора соответственно равны …. 1) +5 и 0 2) +7 и 0 3) +7 и –3 4) +7 и –1
6. Только окислительные свойства проявляет …. 1) НСl 2) НСlО4 3) Сl2 4) НСlО
7. Сера проявляет свойства окислителя в реакции …. 1) S + Fе → 2) S + Сl2 → 3) S + НNО3 → 4) S + О2 →
8. Атом азота может быть и окислителем, и восстановителем …. 1) NН3 и НNО2 2) НNО3 и НNО2 3) NО и NН3 4) NО и НNО2
9. Если свойства иона водорода не учитывать, то свойства и окислителя, и восстановителя может проявлять …. 1) сернистая кислота 2) азотная кислота 3) серная кислота 4) азотистая кислота
10. Процесс окисления описывается схемой …. 1) 3)
11. Процесс окисления описывается схемами: 1) 3)
12. Процесс восстановления описывается схемами: 1) 3)
13. Процесс восстановления описывается схемой …. 1) 3)
14. В растворе может протекать окислительно-восстановительная реакция между …. 1) КМnО4 и Н2S 2) КМnО4 и Н2SО4 3) КМnО4 и Н2SО3 4) КМnО4 и SО3
15. Окислительно-восстановительная реакция может осуществляться между …. 1) НNО3 и SО2 2) НNО3 и Н2SО4 3) НNО3 и Н2S 4) НNО3 и SО3
16. Взаимодействием НNО2 и Н2S можно получить …. 1) NО 2) NО2 3) NО и NО2 4) НNО3
17. Продуктом реакции КМnО4 с НNО2 может быть …. 1) NО 2) НNО3 3) NО и НNО3 4) NО и NО2
18. Стехиометрический коэффициент в уравнении реакции Аg + НNО3 → АgNО3 + NО2 + Н2О перед формулой соли равен …. 1) 1 2) 2 3) 3 4) 4
19. Стехиометрический коэффициент в уравнении реакции КI + Сu(NО3)2 → СuI + I2 + КNО3 перед формулой окислителя равен …. 1) 2 2) 4 3) 1 4) 3
20. Сумма стехиометрических коэффициентов в уравнении реакции МnО2 + КСlО3 + КОН → К2МnО4 + КСl + Н2О перед формулами окислителя и его восстановленной формы равна …. 1) 2 2) 1 3) 3 4) 4
21. Стехиометрический коэффициент в уравнении реакции NаСrО2 + Вr2 + NаОН → Nа2СrО4 + NаВr + Н2О перед формулой восстановителя равен.... 1) 3 2) 8 3) 2 4) 6
22. Сумма стехиометрических коэффициентов в уравнении реакции КI + КNО2 + Н2SО4 → NО + I2 + К2SО4 + Н2О перед формулами восстановителя и его окисленной формой равна.... 1) 1 2) 3 3) 2 4) 4
23. Сумма стехиометрических коэффициентов в уравнении реакции МnО2 + КВr + Н2SО4 → МnSО4 + К2SО4 + Вr2 + Н2О равна …. 1) 4 2) 6 3) 8 4) 10
24. Число атомов хлора в уравнении реакции РbО2 + НСl → РbСl2 + Сl2 + Н2О равен …. 1) 8 2) 9 3) 12 4) 6
25. Кислородом можно окислить …. 1) Ni и Аu 2) Аu 3) Ni
Ni2+ + 2е– = Ni Е0 = – 0, 25 В Аu3+ + 3е– = Аu Е0 = +1, 50 В О2 + 4Н+ + 4е– = 2Н2О Е0 = +1, 23 В
26. Хлором можно окислить …. 1) Мg 2) Аu 3) Мg и Аu Мg2+ + 2е– = Мg Е0 = –2, 36 В Аu3+ + 3е– = Аu Е0 = +1, 50 В Сl2 + 2е– = 2Сl– Е0 = +1, 35 В
27. Реакция 2НIО3 + 5SО2 + 4Н2О
(2IО3– + 12Н+ + 10е– = I2 + 6Н2О, Е0 = +1, 20 В;
SО42– + 4Н+ + 2е– = SО2 + 2Н2О, Е0 = +0, 14 В)
1) протекает справа налево 2) протекает слева направо 3) протекает в обоих направлениях 4) не протекает
28. Реакция Н2S + 2НNО3
(NО3– + 2Н+ + е– = NО2 + Н2О, Е0 = +0, 80 В; S + 2Н+ + 2е– = Н2S, Е0 = +0, 17 В)
1) протекает в прямом направлении 2) протекает в обратном направлении 3) протекает в обоих направлениях 4) не протекает
29. Реакция РbСl2 + Сl2 + 2Н2О
(Сl2 + 2е– = 2Сl–, Е0 = +1, 35 В; РbО2 + 4Н+ + 2е– = Рb+2 + 2Н2О, Е0 = +1, 45 В) не будет протекает в …. 1) прямом направлении 2) обратном направлении 3) обоих направлениях
30. Реакция Zn + КNО3 + 2КОН
(ZnО22– + 2Н2О + 2е– = Zn0 + 4ОН–, Е0 = –1, 22 В; NО3– + Н2О + 2е– = NО2– + 2ОН–, Е0 = +0, 01 В) самопроизвольно протекает в …. 1) прямом направлении 2) обоих направлениях 3) обратном направлении
|

 →
→ 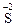 2)
2)  →
→ 
 →
→ 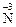 4)
4)  →
→ 
 →
→  2)
2) 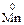 →
→  2)
2)  →
→ 
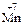 4)
4)  I2 + 5Н2SО4 ….
I2 + 5Н2SО4 ….


