Завдання, предмет і значення загальної та неорганічної хіміїЗагальна хімія являє собою теоретичні основи системи знань про речовини та хімічні процеси. Вона включає чотири фундаментальні вчення: про напрямок хімічних процесів (хімічна термодинаміка) та їх швидкості (хімічна кінетика), теорії будови речовини і періодичності змін властивостей елементів та їх сполук. Неорганічна хімія – наука про хімічні елементи та прості і складні речовини, які вони утворюють. Основні задачі сучасної неорганічної хімії: – вивчення будови, властивостей, хімічних реакцій простих речовин і сполук та взаємозв’язків будови з властивостями і реакційною здатністю речовин; – розробка методів синтезу і глибокої очистки речовин, загальних методів одержання неорганічних матеріалів. Найважливіші розділи неорганічної хімії – теоретична, синтетична та прикладна неорганічна хімія. За об’єктами, які вивчає неорганічна хімія, її поділяють на хімію окремих елементів, хімію груп елементів у складі періодичної системи, хімію певних сполук тих або інших елементів, хімію елементів, що поєднанні в групи за історичними ознаками, хімію близьких за властивостями та використанню речовин. Самостійний розділ неорганічної хімії – хімія координаційних сполук. Як і інші хімічні науки неорганічна хімія нерозривно зв’язана з фізичною хімією, яку можна вважати теоретичною і методологічною основою сучасної хімії, з аналітичною хімією – однією з головних інструментів хімії. Неорганічна хімія дотична з органічною хімією, особливо з хімією елементорганічних сполук, біонеорганічною хімією та ін. Теоретичні уявлення неорганічної хімії використовуються в геохімії, космохімії, хімії твердого тіла, хімії високих енергій, радіохімії, ядерній хімії, у деяких розділах біохімії та агрохімії. Прикладна частина неорганічної хімії зв’язана з хімічною технологією, металургією, електронікою, видобутком корисних копалин, виробництвом кераміки, будівельних, конструкційних, а також оптичних та інших неорганічних матеріалів, з забезпеченням роботи енергетичних установок (наприклад АЕС), з сільським господарством, зі знешкодженням промислових відходів, охороною природи та ін. 1.2. Основні поняття та закони хімії Атом – найменша, хімічно неподільна частинка. Атом – найменша електронейтральна частинка елемента, яка складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки. Хімічний елемент – сукупність атомів з однаковим зарядом ядра. У природі елементи існують у формі простих та складних речовин. Усі хімічні речовини поділяються на два типи: прості та складні. До простих відносяться речовини, молекули яких складаються з атомів одного елементу (наприклад, О2, О3, Н2). Молекули складних речовин складаються з атомів різних елементів (наприклад, Н2О, КОН, СаСО3). Молекула – найменша частинка речовини, яка зберігає її хімічні властивості. Наприклад, навіть одна молекула сульфатної кислоти реагує з магнієм:
(фізичні властивості речовини молекула не зберігає, так як ці властивості притаманні не одній молекулі, а їх сукупності. Наприклад, фізичний параметр – температура кипіння – обумовлюється розривом зв’язків між молекулами). Йон – атом або група атомів, у яких з’являється заряд внаслідок віддачі чи приєднання електронів. Молекулярна формула – зображення кількісного та якісного складу молекули за допомогою хімічних символів та індексів. Наприклад: Н3РО4 – формула фосфатної кислоти, яка показує, що у молекулу цієї речовини входять елементи Гідроген, Фосфор та Оксиген у співвідношенні 3: 1: 4. Формули поділяють на молекулярні, структурні, просторові, електронні. Молекулярні в свою чергу поділяються на найпростіші (емпіричні) та істинні. Перші показують лише кількісне співвідношення атомів елементів, не вказуючи їх істинної кількості. Істинна формула відображає кількісний та якісний склад молекули. Наприклад: найпростіша формула бензену – СН, істинна – С6Н6. Структурні формули відображають взаємне розташування атомів у молекулі. Хімічні символи та формули можна використовувати для запису хімічних рівнянь, які описують хімічні реакції. Хімічні рівняння – це якісне та кількісне описання хімічного процесу, яке включає вихідні речовини та продукти реакції, при цьому, ліва та права частина повинні містити однакову кількість атомів кожного елемента. Для цього використовують стехіометричні коефіцієнти. При складанні хімічних рівнянь ніколи не можна змінювати формули хімічних речовин. Маси атомів та молекул знаходяться в інтервалі від 1·10-24 до 1·10-22 г. Для вираження їх маси використовують спеціальну одиницю – атомну одиницю маси (а.о.м.): 1 а.о.м. дорівнює масі 1/12 частини атому ізотопу 12С 1 а.о.м. = 1, 67·10-24 г У періодичній системі надана середнєізотопна відносна атомна маса, розрахована з урахуванням співвідношення ізотопів у природі. Відносна атомна маса (Ar(Х)) – показує у скільки разів маса даного атому більше, ніж маса 1 а.о.м. Це безрозмірна величина. Наприклад, відносна атомна маса Натрію дорівнює 23:
Відносна молекулярна маса (Mr(Х)) – показує у скільки разів маса молекули речовини більше, ніж маса 1 а.о.м. Це безрозмірна величина. Якщо при величині вказано одиниці її виміру, то це є абсолютна, а не відносна величина. Наприклад, маса частинок може бути виражена у кг (або кратних йому г, мг), у а.о.м., у каратах (дорогоцінне каміння), у футах, пудах та ін. Наприклад, маса одного атома Натрію дорівнює 23 а.о.м. або 23·1, 67·10-24 (г). Моль – одиниця кількості речовини. Моль – особливе поняття, яке базується на практичному досвіді людей. Для зручності дрібні предмети упаковують по 10, 100, 1000 штук, а сипучі продукти – у тару з певною зазначеною масою. Аналогічно цьому у хімії та фізиці використовують одиницю кількості речовини – моль. Це можна вважати умовною упаковкою мікрочастинок. Моль – це кількість речовини, яка містить стільки структурних елементів, скільки атомів Карбону міститься у наважці 12 г ізотопу Карбону 12С. Структурними елементами можуть бути атоми, молекули, йони, електрони, еквіваленти та ін. У 0, 012 кг ізотопу Карбону 12С міститься число атомів, яке дорівнює числу Авогадро NA = 6, 02·1023 1/моль. Моль – безліч, яка складається з числа Авогадро об’єктів (частинок). Число моль речовини називають кількістю речовини, яка позначається – ν (інколи n):
m(Х) – маса речовини; М(Х) – молярна маса речовини.
n – число частинок речовини; NA – число Авогадро. Молярна маса – маса (у грамах) одного моля речовини. Цю фізичну величину зручно використовувати у розрахунках. Молярна маса позначається: М(Х) г/моль, де Х – формула речовини. Завдяки використанню числа Авогадро можна перейти від кількісного співвідношення молекул у рівняннях хімічних реакцій до співвідношень вагових, що необхідно для практичного використання будь-яких хімічних процесів. Наприклад, рівняння синтезу амоніаку 3H2 + N2 = 2NH3 розглянемо на молекулярному, молярному та ваговому рівнях. Молекулярний рівень: 3 молекули H2 + 1 молекула N2 = 2 молекули NH3 Молярний рівень: помножемо кожен член рівняння на NA частинок 3 молекули (H2)·NA + 1 молекула (N2)·NA = 2 молекули (NH3)·NA або 3 моль H2 + 1 моль N2 = 2 моль NH3 Ваговий рівень: 3 моль·2 г/моль H2 + 1 моль·28 г/моль N2 = 2 моль·17 г/моль NH3 або 6 г (H2) + 28 г (N2) = 34 г (NH3) Виходячи з вагового співвідношення, можна обрахувати будь-які практичні процеси. Розрахунки базуються на основних законах хімії. Закон збереження маси – сумарна маса вихідних речовин реакції дорівнює сумарній масі продуктів реакції. Закон сталості складу – якісний та кількісний склад сполук з молекулярною будовою не залежить від місця та методу їх одержання. Наприклад, речовина вода може бути одержана декількома методами: 1. 2Н2 + О2 → 2Н2О 2. NaOH + HCl → NaCl + H2O 3. CuSO4·5H2O → CuSO4 + 5H2O При цьому склад води однаковий – H2O.
|


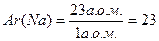
 [моль], де
[моль], де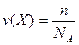 [моль], де
[моль], де


